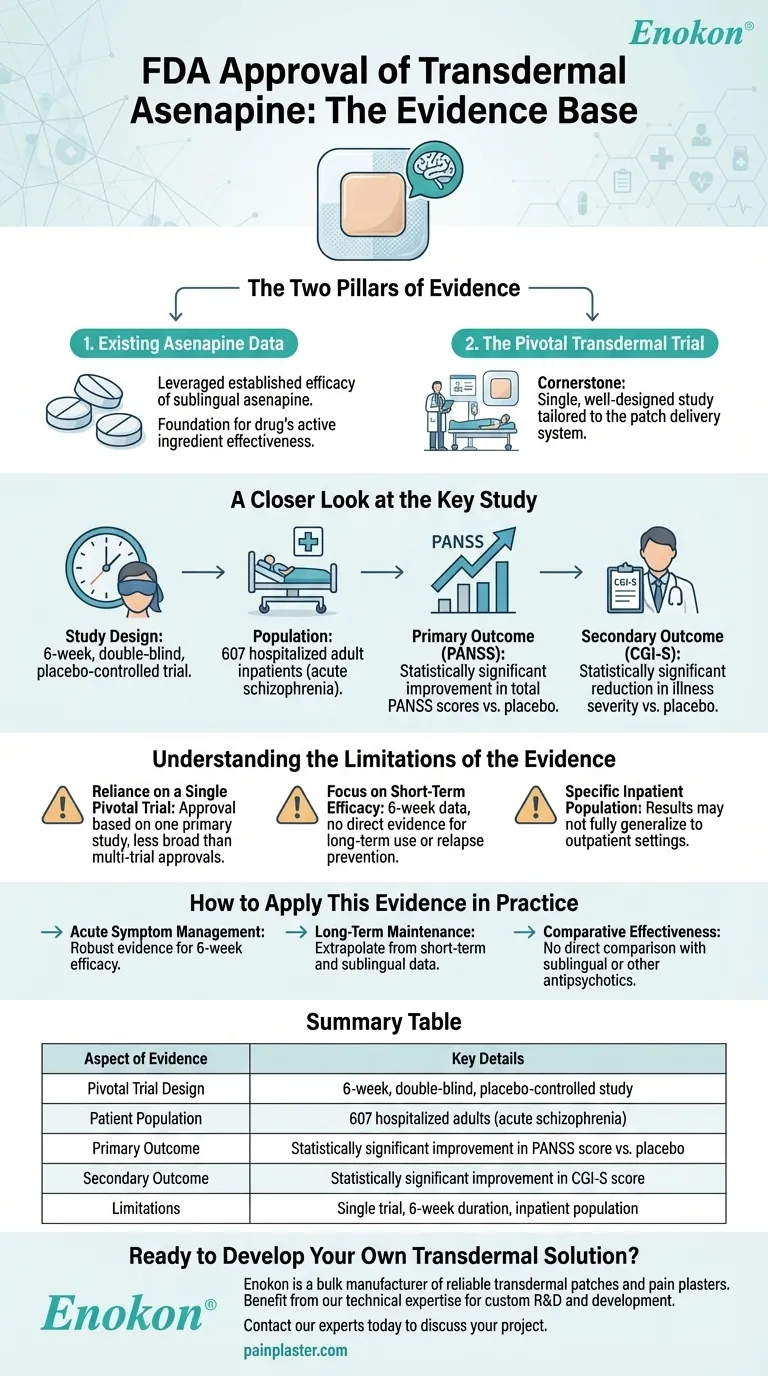
FDAの承認 アセナピンパッチ (経皮吸収型アセナピン製剤)は、舌下投与によるアセナピンの有効性データと、607名の成人統合失調症入院患者を対象とした6週間の二重盲検プラセボ対照試験により裏付けられた。経皮吸収型製剤は、主要評価項目(PANSSスコア)および副次評価項目(CGI-S評価)のいずれにおいても、プラセボと比較して統計学的に有意な改善を示し、治療上の有用性が確認された。これらのエビデンスにより、統合失調症治療における本剤の安全性、有効性、臨床的妥当性が証明された。
キーポイントの説明
-
舌下アセナピンの先行有効性データ
- アセナピン舌下製剤を評価した先行試験により、アセナピンの作用機序や統合失調症における治療可能性に関する基礎的なエビデンスが得られた。
- これらの試験により、経皮吸収型製剤の投与量、安全性プロファイル、期待される結果が明らかになり、承認への道筋がスムーズになったものと思われる。
-
重要な6週間二重盲検試験
- 試験デザイン:607名の参加者による厳密なプラセボ対照試験により、統計的検出力が確保され、バイアスが最小化された。
- 母集団:成人の統合失調症入院患者を対象としている。
- 投与期間:6週間という時間枠は、急性症状の評価と実際の臨床応用のバランスをとった。
-
主要評価項目PANSSスコア
- 陽性・陰性症状評価尺度(PANSS)は、精神分裂病の症状の重症度を評価するためのゴールドスタンダードである。
- PANSSスコアが統計学的に有意に改善したことから、陽性症状(幻覚など)と陰性症状(社会的引きこもりなど)の両方に対するパッチの有効性が確認された。
-
副次評価項目CGI-S評価
- Clinical Global Impression-Severity(CGI-S)尺度は、臨床医が報告する症状改善の検証を提供した。
- ここでの意義は、患者特異的で観察可能な臨床的有益性を補強するものであった。
-
安全性と忍容性
- 参考文献には明確に詳述されていないが、FDAの承認は経皮吸収型製剤が安全性基準を満たしたことを意味し、おそらく舌下投与データと新規試験の有害事象報告を活用したものと思われる。
- 経皮投与は、全身的な副作用の軽減(例えば、経口または注射ルートと比較して)といった利点をもたらす可能性がある。
-
規制上の理由
- FDAの決定は、再現性のある有効性(PANSS/CGI-S)と対照試験データに裏付けられた明確なリスク・ベネフィット・プロファイルにかかっていた。
- パッチの利便性とアドヒアランスの利点(例えば、徐放性、非経口経路)は、服薬コンプライアンスがしばしば問題となる集団に対する承認をさらに正当化した可能性がある。
医療機関の購入者にとって、このエビデンスは以下の点を強調するものである。 アセナピンパッチ は、統合失調症管理のためのエビデンスに裏付けされた有効な選択肢であり、投与と忍容性に潜在的な利点があります。経皮吸収型製剤は患者のニーズや施設のプロトコールに合致するだろうか?
要約表
| FDA承認のための主要エビデンス | 詳細 |
|---|---|
| 舌下アセナピンの先行データ | 確立された作用機序と安全性プロファイル |
| 主要6週間試験 | 成人統合失調症入院患者607例、二重盲検、プラセボ対照 |
| 主要評価項目(PANSSスコア) | 統計学的に有意な症状軽減 |
| 副次評価項目(CGI-S評価) | 臨床医が確認した重症度の改善 |
| 安全性と忍容性 | FDAのベンチマークを満たし、アドヒアランス上の利点が期待できる |
| 規制上の理由 | 再現性のある有効性と明確なリスク・ベネフィット・プロファイル |
経皮吸収型アセナピンを治療プロトコールに組み込むことに関心がありますか?
経皮吸収型テープ製剤・貼付剤の製造・販売ならエノコンにお任せください、 エノコン は、医療販売業者や医薬品ブランド向けに、臨床的に検証された信頼性の高いソリューションを提供しています。カスタムR&Dの専門知識により、患者さんのニーズに合わせた製剤をお約束します。
お問い合わせ パートナーシップのご相談や製品サンプルのご請求はこちらまで。
ビジュアルガイド
関連製品
- 喘息用咳・痛み止めパッチ(大人・子供用
- メントール・ジェル・ペイン・リリーフ・パッチ
- アイシーホット・メンソール薬用痛み止めパッチ
- 遠赤外線ディープヒートリリーフパッチ 薬用痛み止めパッチ
- ハーバル眼保護パッチ アイパッチ















