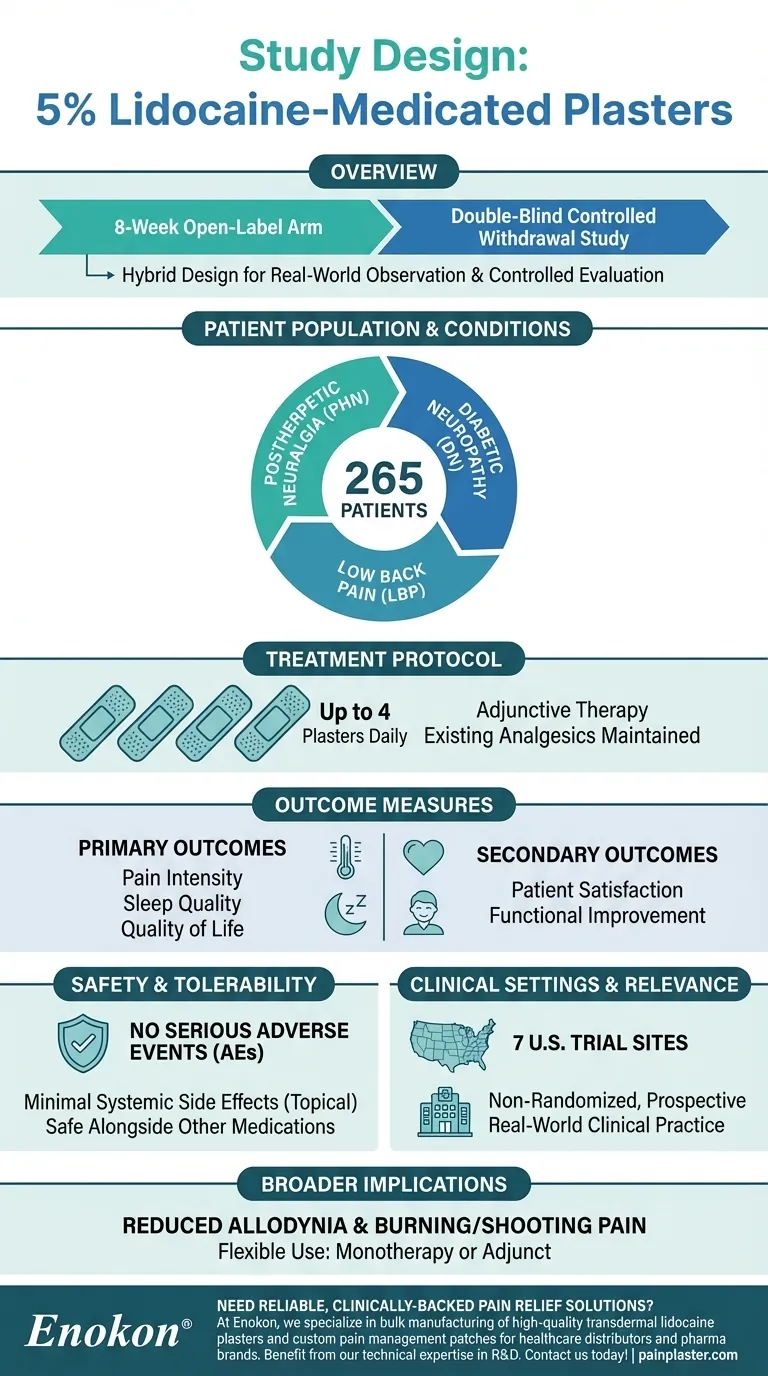
リドカイン5%配合の絆創膏を用いたこの研究は、二重盲検比較試験の8週間の非盲検群としてデザインされた。この試験の目的は、帯状疱疹後神経痛(PHN)やその他の神経障害性疼痛を有する患者を対象に、痛み、睡眠、QOL、患者の満足度に対する絆創膏の影響を評価することであった。複数の臨床試験施設で実施されたこの研究では、患者は既存の鎮痛レジメンを維持しながら、痛みが最も強い部位に1日4枚まで貼付することができた。デザインは、参加者を無作為化せず、自己報告によるアウトカムに注目することで、実臨床での適用性を重視した。
キーポイントの説明
-
研究デザインと期間
- 本試験は 8週間の非盲検群 より大規模な 二重盲検比較離脱試験 .
- オープンラベルとは、研究者と参加者の双方が投与される治療法を知っていることを意味し、二重盲検期(ここでは詳述しない)では盲検比較となる。
- このハイブリッドデザインにより、最初の実臨床観察(オープンラベル)に続いて、コントロールされた評価(二重盲検)が可能となった。
-
患者集団と病態
- 登録患者数 265名の患者 の 帯状疱疹後神経痛(PHN) 帯状疱疹後の神経痛の一種。
- この絆創膏は、次のような他の神経障害性疼痛の状態についても評価された。 痛みを伴う糖尿病性神経障害(DN) そして 腰痛(LBP) .
- 参加者はパッチを痛みの強い部分に貼った。 パッチを貼った。 局所神経障害性疼痛に対する標的治療を反映したものである。
-
治療プロトコル
- 患者 リドカイン5%絆創膏を1日4枚まで使用。 24時間ごとに交換した。
- 絆創膏は 補助療法 つまり、患者は用量を調整することなく既存の鎮痛薬レジメンを継続した。
- この方法は、絆創膏と他の疼痛管理戦略との適合性を検証するものであった。
-
アウトカム評価
- 主要評価項目:痛みの強さ、睡眠の質、生活の質。
- 副次的アウトカム:患者満足度と機能改善
- データは 自己申告 患者中心の指標を重視
-
安全性と忍容性
- なし 重篤な有害事象(AE) または薬物相互作用が報告された。
- 絆創膏の 外用 は全身的な副作用を最小限に抑え、他の薬剤と併用することを支持した。
-
臨床現場と実社会との関連性
- 米国内の 米国の7つの治験施設 大規模な教育病院を含む米国内の7つの治験施設。
- この 非ランダム化前向きデザイン 日常臨床を反映した観察データを優先した。
-
より広範な意義
- アロディニア症(痛みを伴わない刺激による痛み)の軽減に有効である。 アロディニア(痛みを伴わない刺激による痛み) そして 焼けるような痛み PHNに伴う
- 絆創膏の役割を強調した。 単独療法または補助療法 疼痛管理プロトコルに柔軟性を与える
非盲検観察と対照評価を組み合わせることにより、この研究は、神経障害性疼痛患者の疼痛とQOLの改善における絆創膏の臨床的有用性を示す確かな証拠を提供した。

総括表
| アスペクト | 詳細 |
|---|---|
| 試験デザイン | 二重盲検比較試験の8週間非盲検群 |
| 対象患者 | PHN、糖尿病性ニューロパチー、腰痛症患者265名 |
| 治療プロトコル | 5%リドカイン絆創膏を1日4枚まで、既存の鎮痛薬に補助的に使用する。 |
| 主要評価項目 | 痛みの強さ、睡眠の質、QOL |
| 副次的アウトカム | 患者満足度、機能改善 |
| 安全性 | 重篤な有害事象なし、全身的な副作用は最小限 |
| 臨床設定 | 米国7カ所の試験施設、非ランダム化デザインによる実世界との関連性 |
信頼性が高く、臨床的裏付けのある疼痛緩和ソリューションが必要ですか?
エノコン
エノコン
エノコン社は、高品質の経皮リドカインプラスターとカスタム疼痛管理パッチのバルク製造を専門としています。当社の製品は、エビデンスに基づく患者中心のソリューションを求める医療販売業者や製薬ブランド向けに設計されています。当社の研究開発における技術的専門知識を活用し、神経障害性疼痛のためのオーダーメイド製剤を開発してください。
お問い合わせ
パートナーシップのご相談やサンプルのご請求はこちらまで!
ビジュアルガイド
関連製品
- よもぎの痛み止めパッチ(首の痛み用
- リドカイン・ハイドロゲル・疼痛緩和パッチ
- 遠赤外線ディープヒートリリーフパッチ 薬用痛み止めパッチ
- カプサイシン唐辛子薬用鎮痛パッチ
- 背中のための遠赤外線苦痛パッチの救助の苦痛救助者















