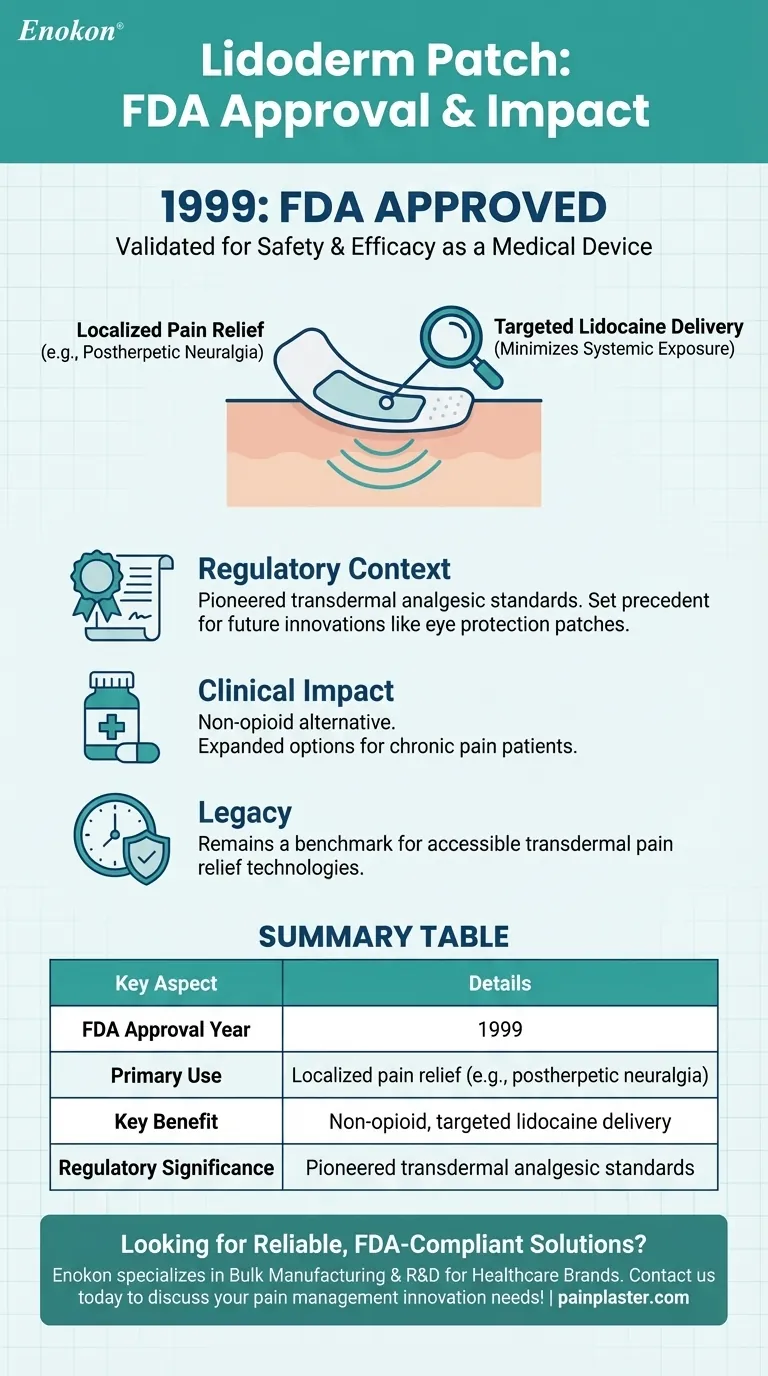
局所鎮痛パッチであるリドダームパッチは、1999年にFDAの承認を受けた。この承認は、リドカインを活用して局所的な治療を提供する、疼痛緩和のための医療機器として導入されたことを意味する。このパッチのデザインと効能は、このような製品に要求される規制基準を満たしており、非侵襲的な疼痛管理ソリューションを必要とする患者への提供を保証するものである。
キーポイントの説明
-
FDA承認年:
- リドダームパッチは1999年に米国食品医薬品局(FDA)により承認された。 1999 .このマイルストーンにより、臨床使用における安全性と有効性が検証された。
- 承認プロセスでは、パッチが全身的な副作用なしにリドカインを効果的に送達する基準を満たすことを確認するための厳格な試験が行われた。
-
目的とデザイン:
- このパッチは、特に帯状疱疹後神経痛(帯状疱疹に関連した痛み)のような症状に対して、局所的な痛みを緩和するように設計されています。
- 粘着性の裏打ちにより、リドカインの標的への送達を可能にし、他の身体部位への曝露を最小限に抑える。
-
薬事規制:
- 1999年にFDAから承認されたリドダームパッチは、初期の局所鎮痛剤のイノベーションのひとつとなった。
- このパッチは、類似製品の先例となった。 眼球保護パッチ を開発した。
-
臨床的インパクト:
- このパッチは、疼痛管理に非オピオイド代替薬を提供するものであり、全身的な薬物使用を減らすことが重視されるようになってきている。
- この承認により、慢性疼痛患者、特に経口薬に過敏な患者の選択肢が広がった。
リドダームパッチは、経皮的鎮痛のベンチマークであり続け、利用しやすいヘルスケア技術の進歩におけるFDAの役割を反映している。
要約表
| 主な側面 | 詳細 |
|---|---|
| FDA承認年 | 1999 |
| 主な用途 | 局所疼痛緩和(帯状疱疹後神経痛など) |
| 主な利点 | 全身への曝露を最小限に抑えた、非オピオイドの標的リドカイン投与 |
| 規制上の意義 | 経皮鎮痛薬規格のパイオニア |
信頼性の高い、FDA準拠の経皮鎮痛ソリューションをお探しですか? エノコン 高品質鎮痛パッチのバルク製造とヘルスケアブランド向けのカスタムR&Dを専門としています。 今すぐお問い合わせください お客様のニーズをお聞かせいただき、疼痛管理イノベーションにおける当社の専門知識をご活用ください!
ビジュアルガイド
関連製品
- ハーバル眼保護パッチ アイパッチ
- リドカイン・ハイドロゲル・疼痛緩和パッチ
- ハイドラ・ジェル・ヘルスケア・アイパッチ
- アイシーホット・メンソール薬用痛み止めパッチ
- 喘息用咳・痛み止めパッチ(大人・子供用
















