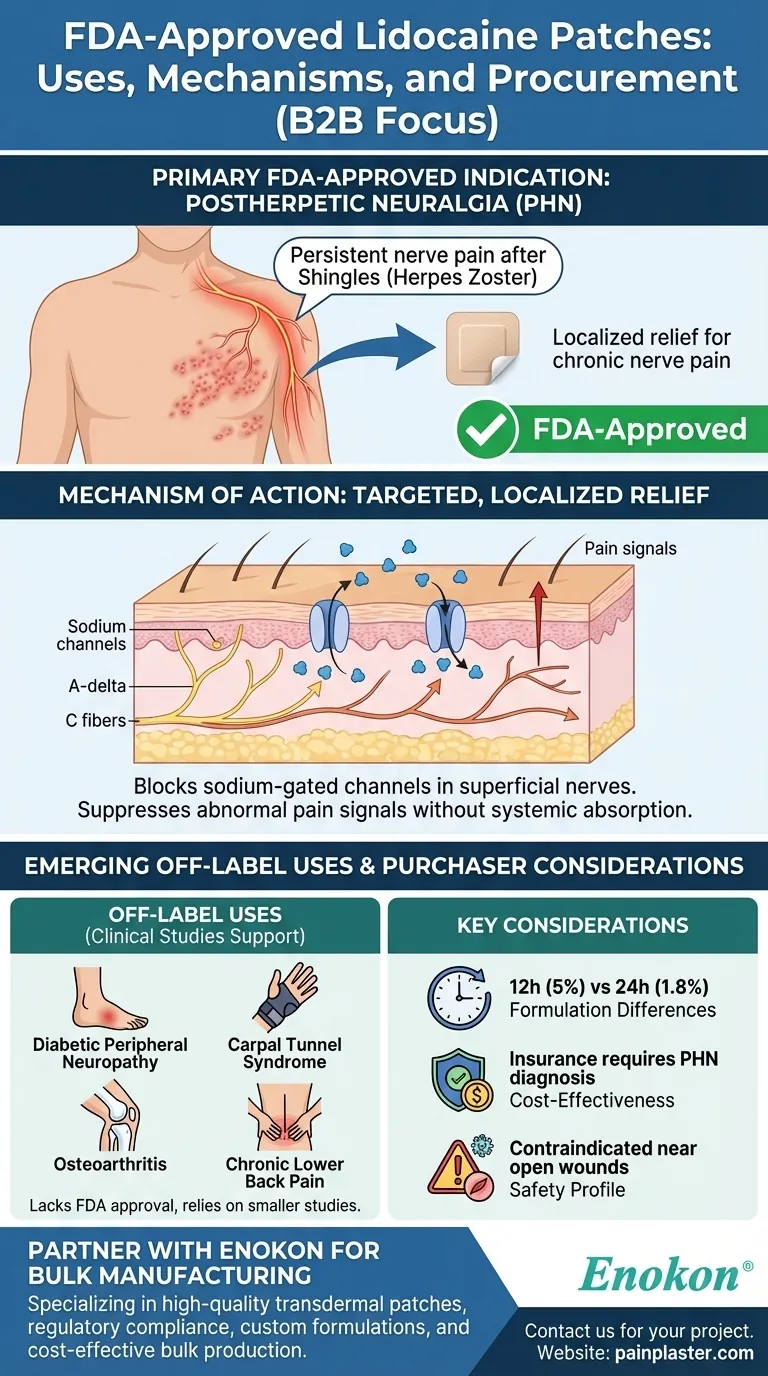
処方 リドカインパッチ は、主に帯状疱疹後の持続的な神経痛の合併症である帯状疱疹後神経痛(Phenpetic Neuralgia:PHN)という特定の症状に対してFDAの承認を受けている。他の神経障害性疼痛や筋骨格系疼痛に対する適応外使用の可能性が研究により示唆されているが、FDAの正式承認は依然としてPHNに限定されている。これらのパッチは、表在神経線維のナトリウムチャネルを遮断することにより局所的な緩和をもたらし、ある種の慢性疼痛を対象とした選択肢となる。
キーポイントの説明
-
FDAが承認した主な適応症帯状疱疹後神経痛(PHN)
- FDAは、帯状疱疹(帯状疱疹感染)後の神経損傷によって引き起こされる慢性疼痛状態であるPHN専用の5%および1.8%処方リドカインパッチを承認しています。
- PHNは、以前に帯状疱疹の発疹に冒された部位の灼熱感、刺痛、知覚過敏として現れ、しばしば数カ月から数年持続する。
-
作用機序
- リドカインパッチは、皮膚のすぐ下に局在するAδおよびC神経線維のナトリウムゲートチャネルを遮断することによって作用する。
- この作用により、全身に吸収されることなく異常な痛みのシグナルを抑制し、内服薬に比べて副作用を最小限に抑えることができる。
-
研究によって裏付けられた適応外使用 FDAは承認していないが、臨床研究では以下のような有効性が示唆されている:
- 糖尿病性末梢神経障害:糖尿病による神経損傷からの痛み。
- 手根管症候群:正中神経の圧迫性ニューロパチー。
- 変形性関節症:関節痛、特に膝などの表層部の痛み。
- 慢性腰痛:特に神経因性成分が存在する場合。
-
購入者への配慮
- 処方の違い:5%パッチ(リドデルムなど)は1日12時間貼付するが、1.8%パッチ(ZTlidoなど)は粘着力が強化されているため24時間貼付が可能である。
- 費用対効果:保険適用には通常、PHNの診断が必要である。適応外使用には事前承認が必要な場合がある。
- 安全性プロファイル:開放創や感染症の近くでは禁忌である。薬物相互作用が少ないため、高齢患者に適している。
-
規制の背景
- FDAの承認は、統計学的に有意な疼痛の軽減を示したPHNに特化した厳密な臨床試験に基づいている。
- 適応外申請は、より小規模な試験や臨床医の経験に依存しており、規制当局による同じレベルの精査を欠いている。
医療機関の購入者にとっては、これらの違いを理解することで、承認された適応症と他の疼痛症候群に関する新たなエビデンスのバランスをとりながら、適切な調達と処方の決定を行うことができる。

要約表
| 主な側面 | 詳細 |
|---|---|
| FDA承認用途 | 帯状疱疹後神経痛(PHN)-帯状疱疹後の慢性神経痛。 |
| 作用機序 | 表在神経のナトリウムチャネルを遮断し、局所の疼痛を緩和する。 |
| 適応外使用 | 糖尿病性神経障害、手根管症候群、変形性関節症、慢性腰痛症 |
| 製剤オプション | 5%パッチ(12時間装着)または1.8%パッチ(24時間装着)。 |
| 安全性と適用範囲 | 全身吸収は最小限。保険適用にはPHN診断が必要な場合が多い。 |
医療施設やブランドにおいて、信頼性の高いFDA準拠のリドカインパッチが必要ですか?
エノコン エノコン エノコンは、処方箋グレードの鎮痛ソリューションを含む、高品質の経皮パッチのバルク製造を専門としています。当社の専門知識は以下を保証します:
- 規制遵守 PHN治療およびその他の疼痛管理のニーズに対応
- カスタム処方 お客様のご要望に合わせた
- 費用対効果の高いバルク生産 ディストリビューターやヘルスケアブランド向け
リドカインパッチの調達やカスタム開発プロジェクトについて リドカインパッチの調達またはカスタム開発プロジェクトについてご相談ください。
ビジュアルガイド
関連製品
- リドカイン・ハイドロゲル・疼痛緩和パッチ
- 喘息用咳・痛み止めパッチ(大人・子供用
- 遠赤外線ディープヒートリリーフパッチ 薬用痛み止めパッチ
- アイシーホット・メンソール薬用痛み止めパッチ
- メントール・ジェル・ペイン・リリーフ・パッチ














