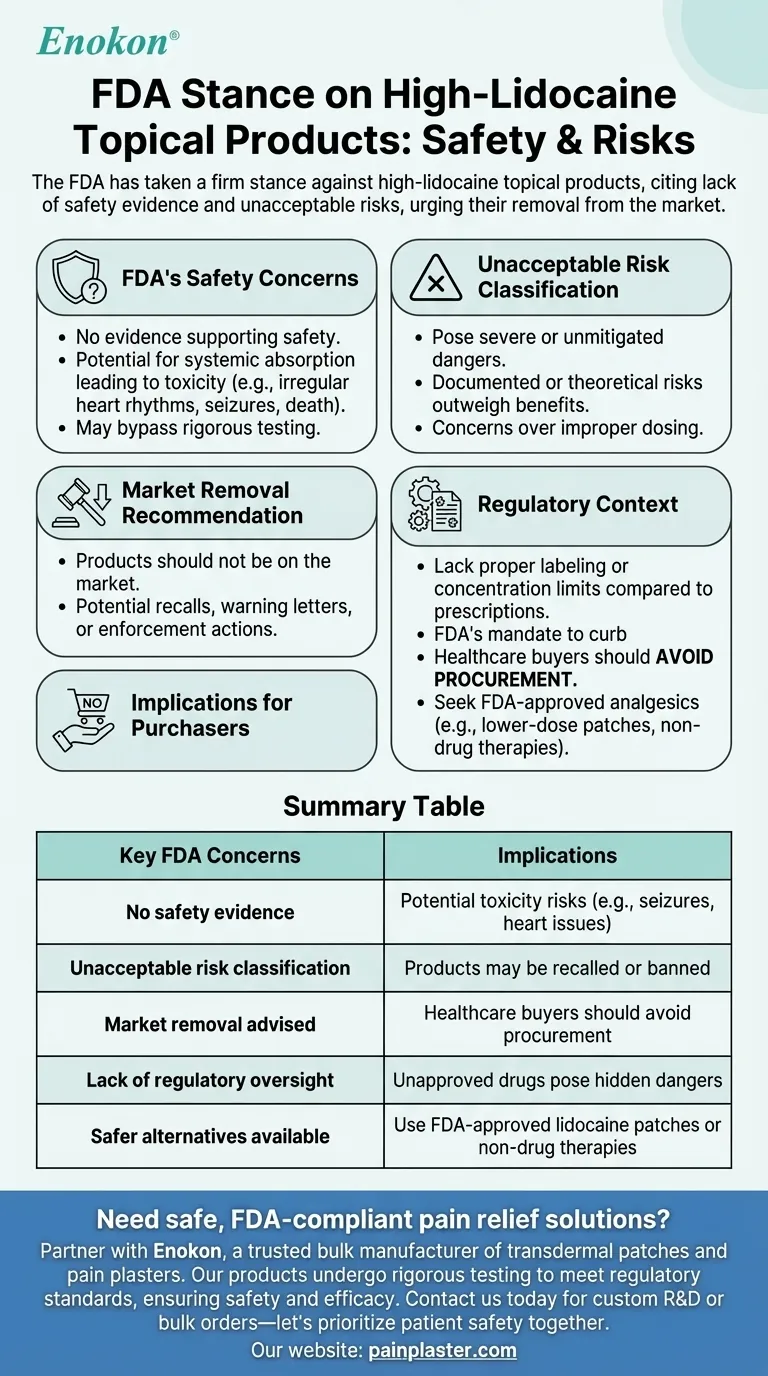
FDAは高リドカイン外用剤に対し、その安全性を示すエビデンスが不足しているとして、消費者に受け入れがたいリスクをもたらすと判断し、断固とした態度を示している。FDAは、これらの製品は潜在的な健康上の危険性があるため、市場に出回るべきではないと明言している。この見解は、検証されていない安全性の主張と、誤用や副作用の可能性に対する懸念を反映したものであり、公衆衛生を守るためのより厳格な規制監督の必要性を強調している。
要点の説明
-
FDAの安全性への懸念
- FDAは 証拠はない 高リ ドカイン外用剤の安全性を裏付ける証拠はない。
- このようなデータの欠如は、全身吸収による毒性(例えば、不整脈、痙攣、極端な場合には死に至ることさえある)などの潜在的リスクについて赤旗を掲げるものである。
- 当局の姿勢は、これらの製品が承認薬に要求される厳格な試験を回避し、その効果に関する不確実性を増大させる可能性があることを示唆している。
-
許容できないリスク分類
- FDAはこれらの製品を以下のように分類している。 許容できないリスク これは、深刻な、あるいは看過できない危険性を持つ品目にのみ許される稀な呼称である。
- これは、文書化された有害事象や理論上のリスク(標準化されていないことによる不適切な投与など)が、認識されている利点を上回ることを示唆している。
-
市場撤去の勧告
- これらの製品は 市場に出回るべきではない は、消費者保護に対するFDAの積極的なアプローチを強調するものである。
- これにより、リコール、製造業者への警告状、販売業者に対する強制措置が促される可能性がある。
-
規制の背景
- 処方用リドカイン(用法用量の管理と臨床的監視がある)とは異なり、OTC高リドカイン製品は適切な表示や濃度制限がない場合がある。
- FDAの見解は、外用薬に見せかけた未承認医薬品を抑制するというFDAの使命に沿ったものである。
-
購入者への影響
- ヘルスケアバイヤーは 調達を避けるべきである。 FDAの懸念が解決されるまで、そのような製品の調達を避けるべきである。
- 代替となるFDA承認の鎮痛剤(例えば、低用量のリドカインパッチや非薬物療法)は、より安全な代替品となりうる。
FDAの警告は、一見良さそうに見えるOTC製品に潜む危険性について重大な注意を喚起するものであり、消費者と専門家の双方に対して、逸話的な主張よりも検証された安全性データを優先するよう促している。

要約表
| FDAの主な懸念事項 | 意味 |
|---|---|
| 安全性の証拠なし | 潜在的毒性リスク(発作、心臓の問題など) |
| 許容できないリスク分類 | 製品の回収または禁止 |
| 市場からの排除を勧告 | ヘルスケアバイヤーは調達を避けるべき |
| 規制当局の監督不足 | 未承認薬は隠れた危険をもたらす |
| より安全な代替薬 | FDA承認のリドカインパッチまたは非薬物療法を使用する |
安全でFDA準拠の疼痛緩和ソリューションが必要ですか? パートナー エノコン エノコン社は、医療販売業者やブランド向けに経皮吸収パッチや鎮痛剤を製造する信頼できるバルクメーカーです。当社の製品は、規制基準を満たすために厳格な試験を受けており、安全性と有効性を保証しています。 お問い合わせ 患者さんの安全を第一に考えましょう。
ビジュアルガイド
関連製品
- リドカイン・ハイドロゲル・疼痛緩和パッチ
- カプサイシン唐辛子薬用鎮痛パッチ
- 遠赤外線ディープヒートリリーフパッチ 薬用痛み止めパッチ
- 熱の冷却パッチのための医学の冷却のゲル パッチ
- アイシーホット・メンソール薬用痛み止めパッチ
















