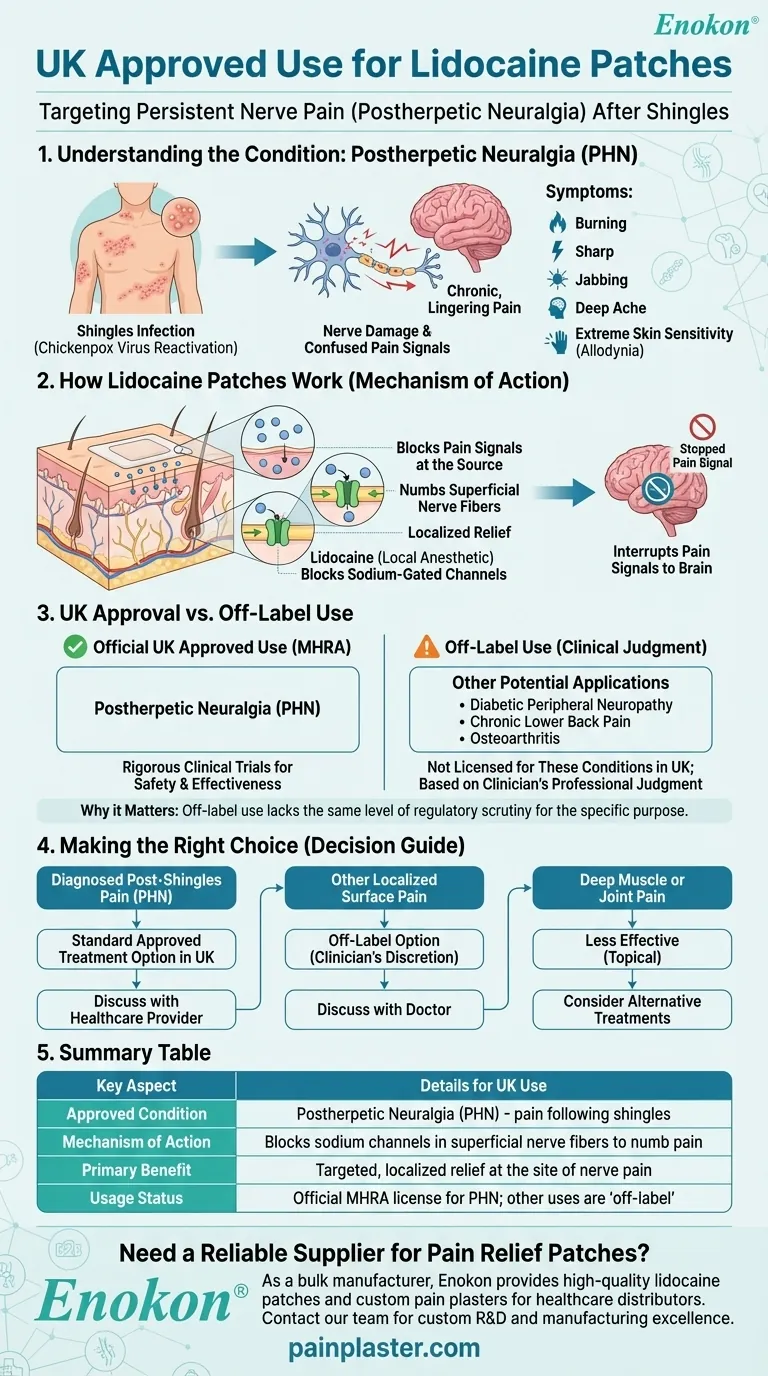
英国における リドカインパッチ は帯状疱疹後神経痛(Phenpetic Neuralgia:PHN)の治療薬として特別に承認されている。他の疼痛症状に対する適応外使用の可能性が研究により示唆されているが、英国の承認はPHN管理に焦点を絞ったものである。これは、疼痛治療のアプローチにおける地域的な規制の違いを反映しており、FDAの広範な承認とは若干異なっている。
キーポイントの説明
-
英国における主な承認適応
- リドカイン貼付剤は、英国において帯状疱疹後神経痛(PHN)の適応で独占的に承認されている。
- PHNは帯状疱疹(帯状疱疹感染)後の神経障害性疼痛症候群であり、以前に罹患した皮膚部位の持続的な疼痛を特徴とする。
-
PHNの作用機序
- パッチは局所的にリドカイン(濃度5%)を投与し、損傷した末梢神経の異常な神経信号を遮断する。
- 局所適用により全身吸収が最小限に抑えられるため、経口鎮痛薬に比べて副作用が軽減される。
-
規制上の背景
- 英国の承認は欧州医薬品庁(EMA)の枠組みに沿ったものであり、通常、特定の適応症については確固たる臨床エビデンスを必要とする。
- FDAとは異なり、英国/EUの規制当局は、新たな研究が進んでいるにもかかわらず、他の神経障害性疼痛疾患(糖尿病性神経障害など)への承認を拡大していない。
-
臨床的考察
- パッチは、痛みのある部位の無傷の皮膚に1日12時間まで直接貼付する。
- 禁忌には、リドカインまたはパッチ成分に対する過敏症が含まれる。
-
適応外使用の可能性
- 英国では未承認であるが、変形性関節症、慢性腰痛症、術後疼痛における有効性を示す研究がある。
- 処方者は、個々の患者のニーズとリスク・ベネフィット評価に基づき、適応外使用を考慮してもよい。
-
購買への影響
- 医療用医薬品の調達は、PHN治療用として英国で承認された製剤を優先すべきである。
- 研究用や拡大用途の場合は、医療機関のプロトコールにより追加的な正当性が要求されるかもしれない。
英国が対象とした承認は、神経障害性疼痛管理に対する慎重なアプローチを反映したものであり、PHNに対するエビデンスに基づく使用を強調する一方で、現在進行中の研究による広範な治療の可能性を認めている。

要約表
| 主な側面 | 詳細 |
|---|---|
| 承認条件 | 帯状疱疹後神経痛(PHN)のみ |
| 作用機序 | 5%リドカインの局所投与による異常な神経信号の遮断 |
| 適用ガイドライン | 無傷の皮膚に1日12時間以上塗布する。 |
| 規制範囲 | EMAに準じた承認(他の神経障害性疼痛疾患に対する英国での適応拡大なし) |
| 適応外の可能性 | 変形性関節症、慢性腰痛(処方者の裁量が必要) |
PHN治療に信頼性の高いリドカインパッチが必要ですか? 経皮鎮痛剤の信頼できるバルクメーカーとして エノコン が提供する
- 英国準拠の製剤 帯状疱疹後神経痛治療剤
- カスタムR&Dサポート ヘルスケアのディストリビューターやブランドのための
- GMP認定製造 安定した品質と有効性を保証
チームへのお問い合わせ 調達または開発ニーズについて今すぐご相談ください!
ビジュアルガイド
関連製品
- リドカイン・ハイドロゲル・疼痛緩和パッチ
- カプサイシン唐辛子薬用鎮痛パッチ
- 遠赤外線ディープヒートリリーフパッチ 薬用痛み止めパッチ
- 喘息用咳・痛み止めパッチ(大人・子供用
- 月経痛緩和のための加熱パッチ
よくある質問
- 5%リドカイン薬用プラスターに関する研究の目的は?疼痛緩和とQOLの評価
- リドカインパッチはどのような症状によく使用されますか?神経痛や外傷による痛みの緩和
- リドカインパッチ5%はどのように適用されたのか?効果的な疼痛管理のための重要な洞察
- リドカインパッチは何に使用されますか?慢性疼痛と神経痛の標的疼痛緩和
- 高リドカイン外用剤の安全性に関するFDAのスタンスは?リスクと規制上の警告
- リドカインナノリポソームについて、粒子径分布測定器はどのようなデータを提供しますか?経皮製剤を最適化しましょう
- リドカインパッチ5%は患者のQOLにどのような影響を与えたか?
- 非処方の経皮リドカインはどのように使用すべきか?安全で効果的な鎮痛ガイド
















